|
Kohlensäure / Kalk-Kohlensäure-Gleichgewicht
Das Kalk-Kohlensäure-Gleichgewicht ist von rein technischer Bedeutung.
Die Aufnahme von Kohlendioxid aus der Atmosphäre erfolgt durch Niederschlagswasser und bei der Passage durch den Boden und den Austausch mit der Bodenluft.
Nur etwa 0,7 % des gelösten CO2 reagiert mit Wasser unter Bildung von Kohlensäure, H2CO3, die in der ersten Stufe in H+ und HCO3--Ionen und in der zweiten Stufe in H+ und CO32- -Ionen dissoziiert.
Definition:
- Das chemische Gleichgewicht zwischen den Ionen der Kohlensäure – dem Kohlendioxid und dem Calciumcarbonat wird als "Kalk-Kohlensäure-Gleichgewicht" bezeichnet.
- Es bestimmt wesentlich den kalkabscheidenden Charakter des Wassers oder den kalkauflösenden
Dissoziation der Kohlensäure
- Löst sich CO2 in Wasser, reagiert es mit Wassermolekülen (H2O)
- Es entsteht Kohlensäure H2CO3
- Die Kohlensäure dissoziiert, d.h. sie zerfällt
- in Hydroniumionen H3O+ (= H+)
- in Hydrogencarbonationen HCO3 - (Bicarbonat)
- in Carbonationen CO32-
CO2 + H2O<--> H2CO3
H2CO3 <--> H + + HCO3-
Die Bildung und Dissoziation der Kohlensäure läuft in 2 Stufen ab und ist stark vom pH-Wert abhängig:
Das Reaktionsgleichgewicht ist vom pH-Wert abhängig:
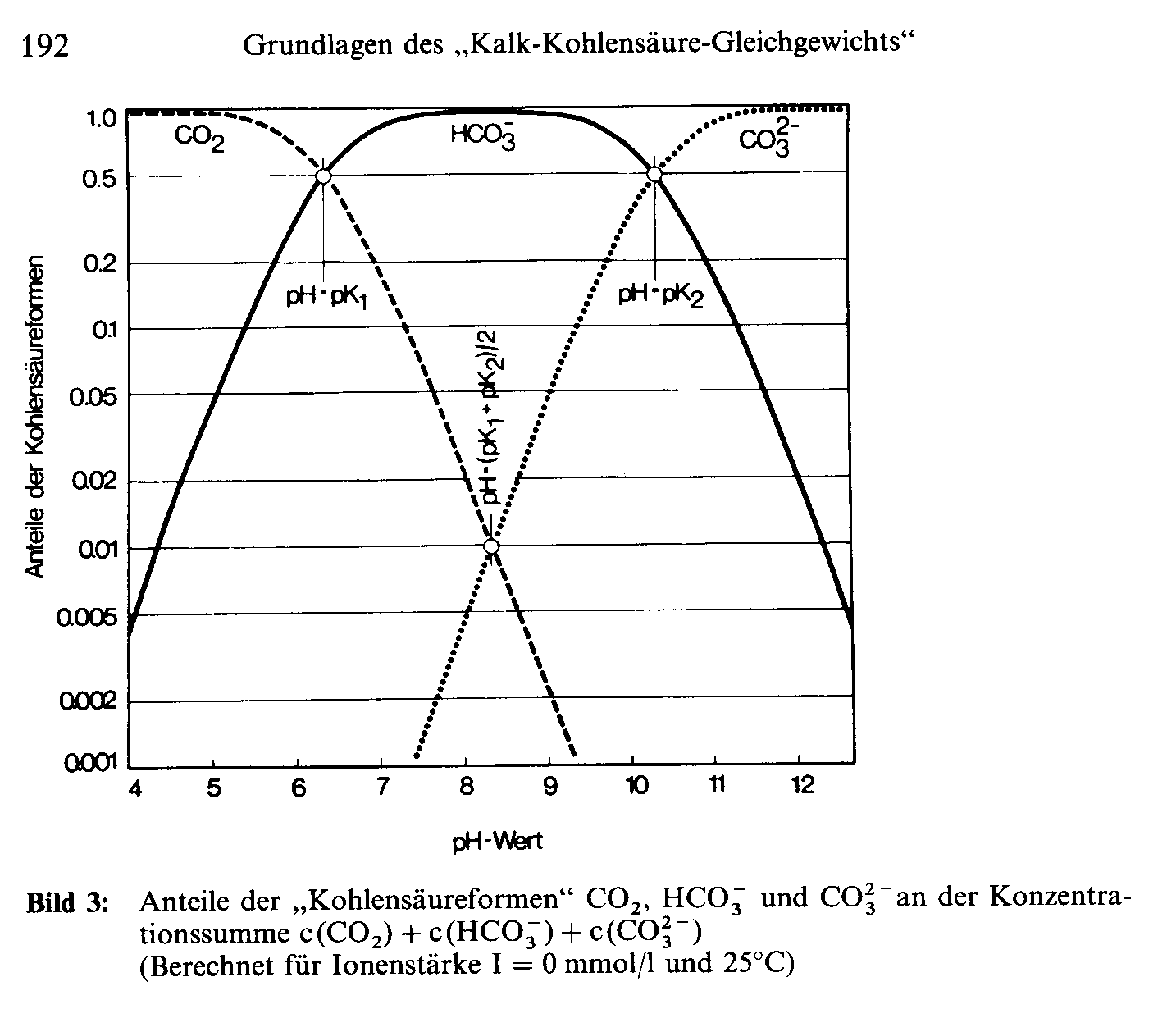
Abb. 1: Anteil der Kohlensäureformen in Abhängigkeit vom pH-Wert
Abb. 1 zeigt die Verteilung der Komponenten des anorganischen Kohlenstoffs (DIC - Dissolved Inorganic Carbon, s. unten) entlang der pH-Achse. Die hier dargestellten Gesetzmäßigkeiten gelten unabhängig von den beteiligten Kationen, also beispielsweise auch für die Lösung von Natriumcarbonat und -hydrogencarbonat. Aus Abb. 1 kann man ablesen, dass bei jedem pH-Wert, der in natürlichen Wässern üblicherweise vorkommt, immer zwei Komponenten des anorganischen Kohlenstoffs in Anteilen von mehr als einem Prozent gemeinsam miteinander existieren. Diese Koexistenz zweier Komponenten wird üblicherweise im Zusammenhang mit der Calcitsättigung als“ zugehörige” Kohlensäure zur anderen Komponente bezeichnet.
In der Vergangenheit hat man die Bezeichnung der Konzentration von Hydrogencarbonat als “Karbonathärte” als Ausgangspunkt genommen und das CO2 als “zugehörig” behandelt. So entstand der Begriff der “zugehörigen Kohlensäure”.
Merke:
Der Anstieg der Konzentration des zugehörigen CO2 beschleunigt sich mit zunehmender Konzentration von Hydrogencarbonat ( = ungefähr Säurekapazität bis pH 4,3). Dies hat eine Reihe wichtiger Konsequenzen:
- - Mit zunehmender Konzentration an Hydrogencarbonat wird jede weitere Konzentrationserhöhung immer aufwändiger, weil der Zusatzbedarf an zugehörigem CO2 überproportional zunimmt. dadurch entsteht eine natürliche Barriere gegen extrem hohe Konzentrationen von Hydrogencarbonat in harten Wässern.
- - Zwei Wässer A und B, die im Zustand der Calcitsättigung befinden, sich aber hinsichtlich ihres Hydrogencarbonatgelhates deutlich unterscheiden, ergeben im Fall einer Mischung Wässer, die sich nicht mehr in der Calcitsättigung befinden. Diese Mischwässer enthalten überschüssiges CO2. Bilden sich solche Wässer z.B. in einem Verteilungssystem, müssen sie daraufhin überprüft werden, ob sie hinsichtlich ihrer Calcitlösekapazität noch innerhalb des vorgegebenen Toleranzbereiches liegen oder ob die unkontrollierte Mischwasserbildung vermieden werden muss.
Arten der Kohlensäure
Freie Kohlensäure liegt fast ausschließlich als CO2 vor, nur etwa 0,7% als hydratisierte Kohlensäure H 2CO3
Kohlensäure kann Calciumkarbonat CaCO3 auflösen und in Calciumhydrogencarbonat umwandeln [Ca(HCO3)2]. Das in Carbonaten gebundene CO2 ist gebundene Kohlensäure, sie zerfällt beim Kochen in Carbonate und CO2
- fest gebundene Kohlensäure ist in Carbonaten CaCO3 gebunden
- halb gebundene Kohlensäure ist in Hydrogencarbonat [Ca(HCO3)2] gebunden
- Hydrogencarbonate würden zerfallen, wenn nicht die sog. freie zugehörige Kohlensäure vorhanden wäre
Ist keine weitere Kohlensäure vorhanden, befindet sich das Wasser im:
- Kalk-Kohlensäure-Gleichgewicht
- Ist weitere Kohlensäure vorhanden, ist dies freie überschüssige Kohlensäure
- --> es ist kein Kalk-Kohlensäure-Gleichgewicht mehr vorhanden!
Aggressives Wasser: bei Vorhandensein freier überschüssiger Kohlensäure, Auflösung von Kalk (Rostschutzschicht)
- Metallaggressiv ist gesamte freie Kohlensäure, also auch freie zugehörige Kohlensäure,
- Herstellung von Wasser im Kalk-Kohlensäure-Gleichgewicht ist in der Aufbereitung erforderlich!
- Kalkaggressiv ist nur der Teil der freien überschüssigen Kohlensäure, da nach Angriff dieser Kohlensäure auf Kalk wieder Ca(HCO3)2 entsteht, das zu seiner Stabilisierung eine weitere Menge an freier zugehöriger Kohlensäure benötigt.
- Beim Fahren der Aufbereitung im Kalk-Kohlensäure-Gleichgewicht in metallischen Rohrleitungen entstehende Schutzschicht besteht aus Kalziumkarbonatkristallen mit Einlagerungen von Magnesium- und Eisenverbindungen
- Die Menge der Kohlensäure ist in technischer Hinsicht sehr wichtig, da Fragen des Materials und der Wasseraufbereitung berührt werden.
Arten der Kohlensäure und ihre Eigenschaften
|
Freie Kohlensäure
|
Gebundene Kohlensäure
|
|
Zugehörige
Kohlensäure
|
Überschüssige
Kohlensäure
|
ganz gebundene
Kohlensäure
|
Halb gebundene
Kohlensäure
|
|
(unschädlich für
Rohrnetze und Beton)
|
(aggressiv)
|
z.B. CaCO3
in Carbonaten
|
in Hydrogencarbonaten
z.B. Ca(HCO3)2
|
|
auch metallaggressiv!
|
- Gesamtüberschuss
Rostschutzschicht-
verhindernd; Rohrangriff;
Metallkorrosion (Cu, Blei, Zink, Fe,..)
- Teilüberschuss
kalkaggressiv;
Betonangriff
|
nicht aggressiv
|
Das Kalk-Kohlensäure-Gleichgewicht ist erreicht, wenn:
Menge der freien Kohlensäure = Menge der zugehörigen (gebundenen) Kohlensäure
- Bei zu geringem Gehalt an freier zugehöriger Kohlensäure kann es zu Kalkausfällung kommen
- Ist mehr freie als zugehörige Kohlensäure vorhanden, dann ist Wasser kalkaggressiv und strebt durch Lösung von Kalk wieder den Gleichgewichtszustand an.
Bei Wässern unterschiedlicher Beschaffenheit ist zu beachten, dass aus zwei Gleichgewichtswässern ein Wasser entstehen kann, dass sich nicht im Gleichgewicht befindet.
Zusammenfassung
|
Wasser ist aggressiv
|
Wasser mit Defizit
|
Gleichgewichtswasser
|
|
mit Überschußkohlensäure =
kalklösend und metallangreifend
|
an zugehöriger Kohlensäure =
kalkabscheidend
|
Wasser steht im
Kalk-Kolensäure-Gleichgewicht = Schutzschichtbildung
|
|
pH-Wert ist niedriger als der Gleichgewichts-pH
|
pH ist höher als der
Gleichgewichts-pH
|
pH-Wert = Gleichgewichts-pH
|
Berechnung der Kohlensäure näherungsweise:
für den Bereich pH 4,3 ... 8,2 gilt:
"freie" Kohlensäure
c(CO2) in mmol/l = p = KB8,2
in mg/l = KB8,2 * 44
halbgebundene Kohlensäure
c(HCO3-) in mmol/l = m= KS4,3 – 0,05
ganz gebundene Kohlensäure
c(CO32-) in mmol/l = 0
anorganisch gebundener Kohlenstoff lässt sich annäherungsweise aus der Säure- und der Basekapazität berechnen:
DIC = KS4,3 – 0,05 + KB8,2 in mmol/l
|